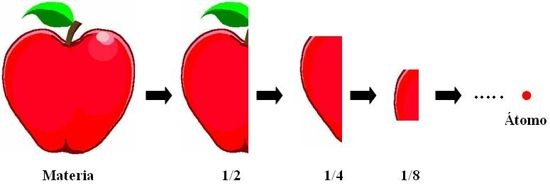
Densidad de la Materia
En si la densidad de la materia es el estado en el que esta la misma, la densidad determina el volumen o cantidad de la sustancia.
Se representa con la letra p: la densidad es igual a la masa sobre el volumen
Energía Potencial, Cinética y Mecánica
Energía Potencial
Es la masa por la gravedad y por la altura, la gravedad siempre tendrá el valor constante de 9,8
Energía Cinética
E igual a un medio por la masa y la velocidad al cuadrado
Energía Mecánica
Es la suma de la energía potencial y cinética.
Modelos Atómicos
Modelo Atómico de Dalton
Lanzo su modelo atómico en 1808 considerado como el padre de la teoría atómica, los principales fundamentos de esta teoría fue:
*La materia esta formada por minúsculas partículas indivisibles llamada átomos
*Los átomos de un mismo elemento poseen la misma propiedad química y los átomos de diferentes elementos tienen distintas propiedades químicas
*Los compuestos se forman combinado átomos de dos elementos
*En las reacciones químicas los átomo se intercambian de una a otra sustancia pero ningún átomo desaparece ni se destruye

Modelo atómico de Thomson
Descubridor del electrón en el cual dicho modelo esta compuesto por electrones de carga negativa y la masa total o general del átomo positiva
Modelo Atómico de Rutherford
Lanzo su modelo atómico en 1911 tomo como ejemplo nuestro sistema solar al plantear que el átomo tiene un núcleo de carga positiva y electrones de carga negativa los electrones giran alrededor del núcleo provocando que el átomo sea electrónica mente neutro.
Modelo Atómico de Bohr
Lanzo su modelo atómico en 1913 tomo el modelo atómico de Bohr pero el núcleo estaba formado por los protónes de carga positiva y mientras los electrones giran alrededor de la misma, un electrón puede salta de un orbital de mayor energía a uno de menor energía.
Modelo Cuántico
El científico Schrödinger lanzo su modelo macano-cuántico en este modelo se dio a conocer que los electrones no son estáticos y que están en el átomo girando alrededor de núcleo es decir que no se puede identificar su posición exacta.
En este modelo se descubrió el neutrón quien es de carga nula y su peso es ligeramente mas alto que el de el protón.
Electrón: Carga negativa gira alrededor del núcleo en sus orbitales
Neutrón: Carga nula forma parte del núcleo del átomo junto con el protón
Protón: Carga positiva forma parte del núcleo del átomo junto con el neutrón
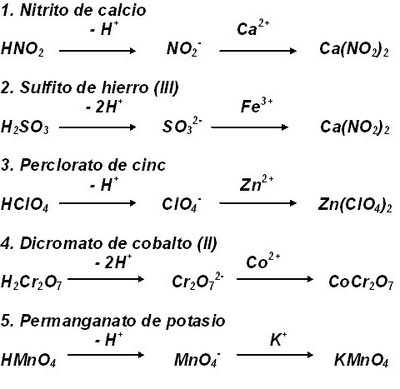
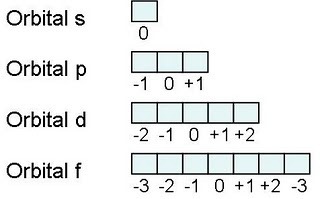
Números Cuánticos
¿Qué son los números cuánticos?
Los números cuánticos son los que nos sirven para encontrar un electrón en su orbital.
Los números cuánticos son 4:
1 El numero cuántico principal
2 El numero cuántico secundario
3 El numero cuántico magnético
4 El numero cuántico espín
Principal ( n ) Determina el nivel de energía en el que esta el electrón
Azimutal Determina el subnivel de energía en el que se encuentra el electrón
Magnético Indica la orientación espacial del subnivel
Espín Determina el giro o sentido en que gira el electrón en su propio eje para determinar su valor:
un medio o - un medio.
Configuración Electrónica
Es la distribución de electrónes en cada nivel de energía, los niveles de energía se representa con letras s, p, d, f.